Procedimiento de detección del alérgeno de mostaza sin a 1 en una muestra alimentaria.
Procedimiento de detección del alérgeno de mostaza Sin a 1 en una muestra alimentaria,
que comprende: (a) extraer las proteínas de dicha muestra alimentaria, (b) reducir las proteínas obtenidas en la etapa (a) con ditiotreitol y alquilar las proteínas con iodoacetamida, (c) digerir el material obtenido en la etapa (b) con tripsina, (d) separar los distintos péptidos presentes en el material digerido obtenido de la etapa (c) por cromatografía líquida acoplada a espectrometría de masas en el modo MRM (Multiple Reaction Monitoring) y (e) identificar la presencia de al menos uno los péptidos identificados por las secuencias SEQ ID NO: 1-5 en dicha muestra alimentaria, donde la presencia de al menos uno de dichos péptidos identificados por las secuencias SEQ ID NO: 1-5 indica la presencia del alérgeno Sin a 1 en dicha muestra alimentaria.
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P201430990.
Solicitante: INSTITUTO DE INVESTIGACIÓN SANITARIA - FUNDACIÓN JIMÉNEZ DÍAZ.
Nacionalidad solicitante: España.
Inventor/es: ALVAREZ LLAMAS,Gloria, VIVANCO MARTINEZ,Fernando, PASTOR VARGAS,Carlos, CUESTA HERRANZ,Javier.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- G01N33/68 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › en los que intervienen proteínas, péptidos o aminoácidos.
Fragmento de la descripción:
campo de la invención
El campo de la invención se refiere a la detección y cuantificación de alérgenos ocultos en alimentos usando espectrometría de masas. La detección de alérgenos de mostaza se realiza detectando la presencia de uno de los alérgenos principales de la mostaza, denominado Sin a 1.
antecedentes de la invención
La mayoría de los kits de pruebas disponibles en el mercado para la detección y cuantificación de los alérgenos en los alimentos productos se basan en técnicas de ELISA (siglas en ingles de Enzyme-Linked ImmunoSorbent Assay, Ensayo por inmunoabsorción ligado a enzimas) o PCR (siglas en ingles de Polymerase Chain Reaction, reacción en cadena de la polimerasa) con límites de detección (LOD) en el rango de 0,1 a 10 mg kg-1 (PPm).
Se han descrito varios métodos de ELISA para detectar trazas de mostaza, permitiendo comercializar Kits de ensayo de ELISA por parte de diferentes empresas. Estos kits de ensayo tienen en general un límite de cuantificación de las proteínas de mostaza cercano a 1 ppm, y son capaces de detectar las proteínas de mostaza de diferentes especies, incluyendo mostaza amarilla y oriental.
El MRM (siglas en inglés de Múltiple Reaction Monitoring) es una metodología de análisis cuantitativo altamente específico, basada en la medición de masas específicas (precursor y fragmentos) correspondientes a la proteína de interés en un espectrómetro de masas (por ejemplo, tipo triple Cuadrupolo (QQQ)).
En las semillas de mostaza amarilla, se han identificado y caracterizado cuatro alérgenos. Sin a 1 y Sin a 2 son proteínas de almacenamiento. Sin a 1 es úna albúmina 2S, úna familia de proteínas altamente estable frente a tratamientos proteolíticos y térmicos. Sin a 2 pertenece a la familia de las globulinas 11S, proteínas compuestas de dominios cupina. Sin
a 3 y Sin a 4 fueron identificadas como una proteína de transferencia de lípidos (LTP) y una profilina, respectivamente. Además, los alérgenos de mostaza Sin a 3 y Sin a 4 mostraron reactividad cruzada con frutas como el melocotón o el melón, respectivamente.
descripción de la invención
La presente invención proporciona un procedimiento de detección del alérgeno de mostaza Sin a 1 en una muestra alimentaria, que comprende:
(a) extraer las proteínas de dicha muestra alimentaria,
(b) reducir las proteínas obtenidas en la etapa (a) con ditiotreitol y alquilar las proteínas con iodoacetamida,
(c) digerir el material obtenido en la etapa (b) con tripsina,
(d) separar los distintos péptidos presentes en el material digerido obtenido de la etapa (c) por cromatografía líquida acoplada a espectrometría de masas en el modo MRM (Múltiple Reaction Monitoring) y
(e) identificar la presencia de al menos uno los péptidos identificados por las secuencias SEQ ID NO: 1-5 en dicha muestra alimentaria, donde la presencia de al menos uno de dichos péptidos identificacos por las secuencias SEQ ID NO: 1-5 indica la presencia del alérgeno Sin a 1 en dicha muestra alimentaria,
en adelante procedimiento de la invención.
El procedimiento de la invención está basado en tecnología de espectrometría de masas acoplada a sistemas cromatográficos para la detección y cuantificación de la presencia de mostaza en alimentos a través de uno de sus alérgenos principales.
Otra realización es el procedimiento de la invención, donde dicha muestra alimentaria es una salsa o una galleta.
texto libre de la lista de secuencias
A continuación se aporta una traducción del texto libre en inglés que aparece en la lista de secuencias.
SEQ ID NO: 1. Péptido proteotítpico 1 de Sin a 1 de mostaza
SEQ ID NO: 2. Péptido proteotítpico 2 de Sin a 1 de mostaza
SEQ ID NO: 3. Péptido proteotítpico 3 de Sin a 1 de mostaza
SEQ ID NO: 4. Péptido proteotítpico 4 de Sin a 1 de mostaza SEQ ID NO: 5. Péptido proteotítpico 5 de Sin a 1 de mostaza
BREVE DESCRIPCIÓN DE LAS FIGURAS
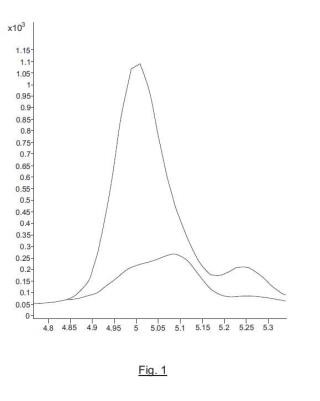
Figuras 1-5. Transiciones optimizadas del ensayo de MRM en el análisis de Sin a 1. El eje x representa minutos y el eje y representa "cuentas". Las figuras muestran 5 péptidos correspondientes a Sin a 1. Figura 1, péptido identificado por la secuencia SEQ ID NO: 4; Figura 2, péptido identificado por la secuencia SEQ ID NO: 5; Figura 3, péptido identificado por la secuencia SEQ ID NO: 1; Figura 4, péptido identificado por la secuencia SEQ ID NO: 3; Figura 5, péptido identificado por la secuencia SEQ ID NO: 2. Cada cromatograma tiene sus correspondientes transiciones. Se entiende por transición a la medida de un fragmento o m/z específica que procede de un péptido precursor concreto y previamente seleccionado.
Figuras 6-12. Cromatogramas de extractos alimentarios de salsas comerciales. El eje x representa minutos y el eje y representa "cuentas". Figura 6, muestra E1: salsa de mostaza; Figura 7, muestra E2: mayonesa de ajo; Figura 8, muestra E3: salsa barbacoa; Figura 9, muestra E4: salsa de miel y mostaza; Figura 10, muestra E5: kétchup; Figura 11, muestra E6: mayonesa; Figura 12, muestra E7: galletas saladas.
MODOS DE REALIZACIÓN PREFERENTE
Ejemplo 1. Extracto de semilla de mostaza amarilla. Purificación de Sin a 1.
Se obtuvo un polvo de mostaza a partir de semillas de Sinapis alba L. que se resuspendió en tampón de borato de sodio 0,15 M, pH 8, en un 10 % (p/v), se agitó suavemente durante 1 h y se centrifugó a 4 0 C. El precipitado se extrajo dos veces con tampón de borato y los sobrenadantes se liofilizaron. El material resultante fue lavado tres veces con 10 % (p/v) de acetona. Los pellets fueron secados al aire y se disolvieron en bicarbonato de amonio 0,15 M, pH 8,0. Después se centrifugaron a 8.700xg a 4 0 C y los sobrenadantes se liofilizaron y se almacenaron a -200 C.
Sin a 1 se purificó como describieron Menendez-Arias et al. (Menendez-Arias L, Moneo I., Domínguez J., Rodríguez R. Primary structure of the major allergen of yellow mustard (Sinapis alba L.) seed, Sin a I. Eur J Biochem 15-10-1988; 177:159-166.). Brevemente, el extracto de semillas liofilizado se disolvió en tampón bicarbonato de amonio 0,15 M, pH 8.0,
y se aplicó sobre una columna G- 50 Sephadex fine. Las fracciones que contenían la albúminas 2S se juntaron y se resolvieron por cromatografía de intercambio iónico en una columna SP- Sephadex C- 25 equilibrada con tampón de pirofosfato 3 mM, pH 9,0. Las proteínas se eluyeron con un gradiente de 3 a 100 mM de tampón de pirofosfato, pH 9,0. Las fracciones que contenían la proteína se reunieron y resolvieron mediante cromatografía de intercambio iónico en CM-celulosa. Después de un gradiente de NaCI de 0,15 a 0,3 M, las fracciones que contienen Sin a 1 se agruparon.
Ejemplo 2. Extracción de proteínas muestras comerciales
Las salsas comerciales y muestras de galletas (salsa de mostaza, mayonesa de ajo, salsa barbacoa, salsa de miel y mostaza, kétchup, mayonesa y galletas saladas) se adquirieron en un mercado local (Madrid, España). Se suspendió 0,5 g de cada muestra en tampón bicarbonato de amonio 50 mM de pH 8,0, en un relación 10 % (p/v), se agitó suavemente durante 48 horas a 4°C y se centrifugó a 20.000xg, a 4°C. Después de la centrifugación, los sobrenadantes se liofilizaron, se resuspendieron en 0,5 mi de PBS (siglas en inglés de phosphate buffered saline) y se cargaron en una columna Superdex 25 equilibrada en tampón bicarbonato de amonio 50 mM pH 8,0. Las fracciones que contienen las proteínas se liofilizaron y se resuspendieron en 1 mi de tampón bicarbonato de amonio 50 mM de pH 8,0. El contenido total de proteínas fue determinada por Coomassie Plus Assay (Pierce, IL, EE.UU.) y 50 microgramos de proteína total fue tomada para la digestión.
Ejemplo 3. Análisis de los extractos por MRM
Para el análisis por MRM, las proteínas (proteínas purificadas o extractos obtenidos a partir de muestras comerciales) se trataron con ditiotreitol (DTT) y iodoacetamida (IAA). La digestión se realizó con tripsina modificada, a una relación final de 1:50 (tripsina: proteína) para los extractos comerciales (50 microgramos de proteína total digerido) o mediante la adición de 0.2 pg de tripsina a todas las soluciones estándar de Sin a 1 purificada que se utilizaron en la curva de calibración. Las disoluciones con los péptidos trípticos se limpiaron con columnas de centrifugado C18 (Protea Biosciences) de acuerdo con las instrucciones del fabricante, y se diluyeron 1:1 con fase móvil A (ácido fórmico al 0,1 % que contiene 5 % de acetonitrilo). Las muestras fueron analizadas en el modo MRM con un espectrómetro de masas triple Cuadrupolo 6460 (Agilent, LC/MS/MS), conectado a una interfase de HPLC- Chip Cube...
Reivindicaciones:
1. Procedimiento de detección del alérgeno de mostaza Sin a 1 en una muestra alimentaria, caracterizado por que comprende:
(a) extraer las proteínas de dicha muestra alimentaria,
(b) reducir las proteínas obtenidas en la etapa (a) con ditiotreitol y alquilar las proteínas con iodoacetamida,
(c) digerir el material obtenido en la etapa (b) con tripsina,
(d) separar los distintos péptidos presentes en el material digerido obtenido de la etapa (c) por cromatografía líquida acoplada a espectrometría de masas en el modo MRM (Múltiple Reaction Monitoring) y
(e) identificar la presencia de al menos uno los péptidos identificados por las secuencias SEQ ID NO: 1-5 en dicha muestra alimentaria, donde la presencia de al menos uno de dichos péptidos identificacos por las secuencias SEQ ID NO: 1-5 indica la presencia del alérgeno Sin a 1 en dicha muestra alimentaria.
2. Procedimiento según la reivindicación 1, caracterizado por que dicha muestra alimentaria es una salsa o una galleta.
Patentes similares o relacionadas:
Inmunomoduladores, del 29 de Julio de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de la fórmula (I) **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de **(Ver fórmula)** en donde: […]
Métodos y composiciones para el diagnóstico y pronóstico de lesión renal e insuficiencia renal, del 29 de Julio de 2020, de Astute Medical, Inc: Un método para evaluar el estado renal en un sujeto, que comprende: realizar una pluralidad de ensayos configurados para detectar una […]
Neuregulina para tratar la insuficiencia cardíaca, del 29 de Julio de 2020, de Zensun (Shanghai) Science & Technology, Co., Ltd: Neuregulina para usar en un método para tratar la insuficiencia cardíaca crónica en un paciente, donde el paciente tiene un nivel plasmático de NT-proBNP […]
Procedimiento para evaluación de la función hepática y el flujo sanguíneo portal, del 15 de Julio de 2020, de The Regents of the University of Colorado, a body corporate: Procedimiento in vitro para la estimación del flujo sanguíneo portal en un individuo a partir de una única muestra de sangre o suero, comprendiendo el procedimiento: […]
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
Método para llevar a cabo el seguimiento de la enfermedad de Gaucher, del 15 de Julio de 2020, de Centogene GmbH: Un método para determinar la evolución de la enfermedad de Gaucher en un sujeto, que comprende la etapa de determinar en varios puntos en el […]
Biomarcadores de pronóstico y predictivos y aplicaciones biológicas de los mismos, del 1 de Julio de 2020, de INSTITUT GUSTAVE ROUSSY: Un método para evaluar la sensibilidad o la resistencia de un tumor frente a un agente antitumoral, que comprende evaluar la cantidad de complejo eiF4E-eiF4G (complejo Cap-ON) […]
Métodos de monitorización terapéutica de profármacos de ácido fenilacético, del 24 de Junio de 2020, de Immedica Pharma AB: Glicerilo tri-[4-fenilbutirato] (HPN-100) para su uso en un método para tratar un trastorno del ciclo de la urea en un sujeto que tiene discapacidad […]