UN METODO PARA TRATAMIENTO Y PROFILAXIS.
Un agente que inhibe la actividad del factor que estimula la colonia de granulocito (G-CSF),
o el receptor del factor que estimula la colonia de granulocito (G-CSFR) y/o que reduce el nivel de expresión de un gen que codifica dicho G-CSF o GCSFR para el tratamiento o profilaxis de artritis en un sujeto
Tipo: Resumen de patente/invención. Número de Solicitud: W03001078AU.
Solicitante: THE WALTER AND ELIZA HALL INSTITUTE OF MEDICAL RESEARCH.
Nacionalidad solicitante: Australia.
Dirección: 1G ROYAL PARADE,PARKVILLE, VIC 3052.
Inventor/es: METCALF, DONALD, LAWLOR,KATHRYN,ELIZABETH, WICKS,IAN,PETER, CAMPBELL,IAN,KEITH, ROBERTS,ANDREW,WARWICK.
Fecha de Publicación: .
Fecha Concesión Europea: 23 de Septiembre de 2009.
Clasificación Internacional de Patentes:
- A01K67/027 NECESIDADES CORRIENTES DE LA VIDA. › A01 AGRICULTURA; SILVICULTURA; CRIA; CAZA; CAPTURA; PESCA. › A01K CRÍA DE ANIMALES; AVICULTURA; APICULTURA; PISCICULTURA; PESCA; ANIMALES PARA CRIA O REPRODUCCIÓN, NO PREVISTOS EN OTRO LUGAR; NUEVAS VARIEDADES DE ANIMALES. › A01K 67/00 Cría u obtención de animales, no prevista en otro lugar; Nuevas razas de animales. › Nuevas razas de vertebrados.
- A01K67/027M2
- A61K38/19B
- C07K14/535 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › CSF de granulocitos; CSF de granulocitos-macrófagos.
- C07K14/715D
- C07K16/18 C07K […] › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra materiales animales o humanos.
- C07K16/28 C07K 16/00 […] › contra receptores, antígenos celulares de superficie o determinantes celulares de superficie.
- C12N15/85A3
- G01N33/564 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › para complejos inmunológicos preexistentes o enfermedades autoinmunes.
- G01N33/68D
Clasificación PCT:
- A61K38/19 A […] › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Citoquinas; Linfoquinas; Interferones.
- A61K39/395 A61K […] › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- A61K48/00 A61K […] › Preparaciones medicinales que contienen material genético que se introduce en las células del cuerpo vivo para tratar enfermedades genéticas; Terapia génica.
- A61P29/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes analgésicos, antipiréticos o antiinflamatorios que no actúan sobre el sistema nervioso central, p. ej. agentes antirreumáticos; Antiinflamatorios no esteroideos (AINEs).
- C12N15/09 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Tecnología del ADN recombinante.
- C12N15/63 C12N 15/00 […] › Introducción de material genético extraño utilizando vectores; Vectores; Utilización de huéspedes para ello; Regulación de la expresión.
Clasificación antigua:
- A01K67/00 A01K […] › Cría u obtención de animales, no prevista en otro lugar; Nuevas razas de animales.
- A61K38/19 A61K 38/00 […] › Citoquinas; Linfoquinas; Interferones.
- A61K39/395 A61K 39/00 […] › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- A61K48/00 A61K […] › Preparaciones medicinales que contienen material genético que se introduce en las células del cuerpo vivo para tratar enfermedades genéticas; Terapia génica.
- A61P29/00 A61P […] › Agentes analgésicos, antipiréticos o antiinflamatorios que no actúan sobre el sistema nervioso central, p. ej. agentes antirreumáticos; Antiinflamatorios no esteroideos (AINEs).
- C12N15/09 C12N 15/00 […] › Tecnología del ADN recombinante.
- C12N15/63 C12N 15/00 […] › Introducción de material genético extraño utilizando vectores; Vectores; Utilización de huéspedes para ello; Regulación de la expresión.
Fragmento de la descripción:
Un método para tratamiento y profilaxis.
Campo de la invención
La presente invención se relaciona de manera general con un agente para el tratamiento o profilaxis de la artritis o con el uso de un agente en la fabricación de un medicamento para tal un propósito. La presente invención proporciona adicionalmente un método no terapéutico in vivo utilizando un modelo de animal no humano para detectar agentes útiles en el tratamiento o profilaxis de la artritis.
Antecedente de la invención
Al final de la especificación se listan detalles bibliográficos de referencias proporcionadas en la especificación objeto.
La referencia en cualquier técnica anterior en esta especificación no es, y no se debe tomar como, un reconocimiento o cualquier forma de sugerencia ya que esta técnica anterior forma parte del conocimiento general común en cualquier país.
El factor que estimula la colonia de granulocito (G-CSF, codificado por el gen CSF-3) es un factor de crecimiento hematopoyético que regula la producción de granulocitos (Nicola et al., Nature 314: 625, 1985; Metcalf International Journal of Cancer 25: 225, 1980; Nicola et al., Journal of Biological Chemistry 258: 9017, 1983). El G-CSF media sus afectos a través de la interacción con el receptor del factor que estimula la colonia de granulocito (G-CSFR, codificado por el gen CSFR-3), un miembro de la superfamilia del receptor de citoquinas tipo I (Demetri et al., Blood 78: 2791-2808, 1991). Las acciones biológicas principales de GCSF en humanos y ratones, incluyen incrementar la producción y la liberación de neutrófilos de la médula ósea (Souza et al., Science 232: 61, 1986; Lord et al., Proc. Natl. Acad Sci. USA 86:9499-9503, 1989), células progenitoras hematopoyéticas mobilizantes de la médula en la sangre periférica (Bungart et al., British Journal of Haematology 22: 1156, 1990; de Haan et al., Blood 86: 2986-2992, 1995; Roberts et al., Blood 89: 2736-2744, 1997), y modular la diferenciación y funciones efectoras de neutrófilos maduros (Yong et al., European Journal of Haematology 49: 251-259, 1992; Colotta et al., Blood 80: 2012-2020, 1992; Rex et al., Transfusion 35: 605-611, 1995; Gericke et al., Journal of Leukocyte Biology 57: 455-461, 1995; Xu et al., British Journal of Haematology 93: 558-568, 1996; Yong, British Journal of Haematology 94: 40-47, 1996; Jacob et al., Blood 92: 353-361, 1998). El G-CSF se utiliza para tratar neutropenia, así como también la movilización de células madre hematopoyéticas (HSC) para trasplante de célula madre autóloga y alogénica (Welte et al., Blood 88: 1907-1929, 1996).
El uso de G-CSF para la movilización de HSC puede originar exacerbaciones de artritis reumatoide (RA) (Snowden et al., Bone Marrow Transplantation 22: 1035-1041, 1998). El G-CSF junto con los factores de estimulación de colonia, GM-CSF y M-CSF se producen mediante fibroblastos sinoviales de humano y condrocitos en respuesta a IL-1 y TNF in vitro (Leizer et al., Blood 76: 1989-1996, 1990; Hamilton et al., Blood 79: 1413-1419, 1992), y se ha encontrado G-CSF en el suero y el fluido sinovial de pacientes RA (Tanabe et al., Rheumatology International 16: 67-76, 1996; Nakamura et al., Clinical and Experimental Rheumatology 18: 713-718, 2000). Se ha mostrado distribución sistémica de G-CSF por exacerbar la artritis inducida por colágeno de murino (CIA) con severidad e incidencia incrementada de la enfermedad en ratones DBA/1 (Campbell et al., Journal of Leukocyte Biology 68: 144-150, 2000), así como también un modelo de transferencia pasiva CIA en ratas (Miyahara et al., Clinical Immunology and Immunopathology 69: 69-76, 1993). Los ratones transgénicos G-CSF han incrementado la resorpción ósea y la formación ósea reducida (Takahashi et al., Laboratory Investigation 74: 827-834, 1996), lo que indica que el G-CSF puede tener un papel en el recambio óseo.
El G-CSF es capaz de expandir un subconjunto de monocito/macrófago e induce citoquinas antiinflamatorias que pueden proteger contra la endotoxemia en ratones (Gorgen et al., Journal of Immunology 149: 918, 1992). También se ha reportado que el G-CSF deteriora las respuestas de célula T alogénica y mitogénica en humanos y ratones (Foster et al., Transplantation 59: 1557, 1995; Pan et al., Blood 86: 4422, 1995), y por originar un cambio del perfil de citoquina de célula T hacia la producción de citoquina Th2, con una reducción correspondiente en la expresión Th1 IFN-? (Pan et al., 1995, supra; Franzke et al., Blood 102: 734-739). En estudios de murino, esta desviación de la producción de citoquina Th2 se ha asociado con protección aguda contra enfermedad anfitrión versus injerto, encefalomielitis autoinmune experimental (EAE) y lupus eritematoso sistémico espontáneo (Pan et al., 1995, supra; Zavala et al., Journal of Immunology 163: 5125-5132, 1999; Zavala et al., Journal of Immunology 168: 2011-2019, 2000). Los ratones deficientes en G-CSF se protegen de glomerulonefritis mediada por neutrófilo, pero no glomerulonefritis mediada por célula T/macrófago (Kitching et al., Journal of the American Society of Nephrologh 13: 350-358, 2000).
El G-CSF es, por lo tanto, una molécula pleiotrópica con un rango de funciones. Existe una necesidad para caracterizar más completamente estas funciones y para aclarar si la modulación de estas funciones puede conducir a beneficios en la salud.
Resumen de la invención
A través de esta especificación, a menos que el contexto requiera otra cosa, la palabra "comprende", o variaciones tal como "que comprende" o "que comprenden", se entenderá que implica la inclusión de un elemento establecido o entero o grupo de elementos o enteros pero no la exclusión de cualquier otro elemento o entero o grupo de elementos o enteros.
Se estudia el papel de los neutrófilos en un modelo de artritis de murino. El modelo de murino incluye el uso de anticuerpos para agotar neutrófilos así como también el uso de un ratón knockout G-CSF. Se determina que estos ratones son altamente resistentes a la inducción de artritis aguda, pero este efecto no parece ser explicado por los conteos menores de neutrófilos. Se encuentra de forma similar que el G-CSF puede inducir directamente inflamación de la articulación mediante la administración local y que el GCSF sistémico puede sustituir IL-1 en el modelo de artritis aguda.
La artritis inducida por colágeno (CIA) es un modelo autoinmune crónico ampliamente utilizado para investigar la patogenia de la artritis reumatoide (RA) y para la evaluación de terapias prospectivas. Para examinar el requerimiento de G-CSF endógeno en la enfermedad de articulación crónica, se inmunizan ratones G-CSF-/- y tipo intacto (WT) con colágeno de pollo de Tipo II (CII) En Adyuvante Completo de Freund (CFA) para inducir CIA. Existe protección marcada de enfermedad en ratones deficientes en G-CSF, identificando un papel principal para G-CSF en CIA. Las respuestas de célula T a CII son normales en ratones transgénicos G-CSF.
De forma colectiva, esto muestra que el G-CSF endógeno juega un papel importante en la artritis inflamatoria. La actividad G-CSF de descenso, que reduce localmente o sistémicamente los niveles de G-CSF o inhibe o el descenso del receptor G-CSF (G-CSFR), se propone por ser un mecanismo útil para tratar o reducir la severidad de afecciones inflamatorias tal como artritis inflamatoria crónica y artritis reumatoide u otras afecciones de enfermedad inflamatoria crónica inmunocomprometida.
De acuerdo con lo anterior, la presente invención contempla un uso de un agente que inhibe la actividad de G-CSF o GCSFR y/o que reduce el nivel de expresión de un gen que codifica dicho G-CSF o G-CSFR en la fabricación de un medicamento para la profilaxis y/o tratamiento de artritis en un sujeto.
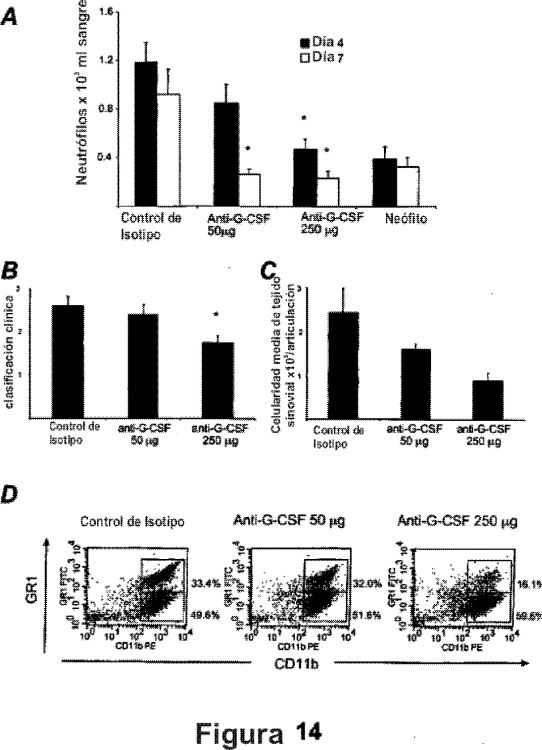
La eficacia terapéutica de la administración de un anticuerpo monoclonal neutralizante (mAb) para G-CSF se prueba en el modelo de artritis aguda. La inhibición de G-CSF durante la artritis aguda resulta en una reducción dependiente de dosis en células de linaje mieloide en el BM, neutropenia en la sangre periférica y reduce la infiltración celular de la articulación involucrada.
La presente invención proporciona adicionalmente un agente que inhibe la actividad de G- CSF o G-CSFR y/o que reduce el nivel de expresión de un gen que codifica G-CSF o G-CSFR para el tratamiento o profilaxis de artritis...
Reivindicaciones:
1. Un agente que inhibe la actividad del factor que estimula la colonia de granulocito (G-CSF), o el receptor del factor que estimula la colonia de granulocito (G-CSFR) y/o que reduce el nivel de expresión de un gen que codifica dicho G-CSF o GCSFR para el tratamiento o profilaxis de artritis en un sujeto.
2. El agente de la reivindicación 1, en donde la artritis es artritis inflamatoria crónica o artritis reumatoide (RA) o artritis inducida por colágeno (CIA).
3. El agente de una cualquiera de las Reivindicaciones 1 o 2, en donde el sujeto es un animal o especie aviar.
4. El agente de la reivindicación 3, en donde el animal es un mamífero.
5. El agente de la reivindicación 4, en donde el mamífero es un primate o roedor.
6. El agente de la reivindicación 5, en donde el primate es un humano o el roedor es un ratón.
7. El agente de una cualquiera de las Reivindicaciones 1 a 6, en donde el agente es in anticuerpo para G-CSF o G-CSFR o un epítopo del mismo.
8. El agente de la reivindicación 7, en donde el anticuerpo es un anticuerpo monoclonal o un anticuerpo policlonal.
9. El agente de una cualquiera de las Reivindicaciones 1 a 6, en donde el agente es una forma soluble deG-CSFR.
10. El agente de una cualquiera de las Reivindicaciones 1 a 6, en donde el agente es un análogo químico de G-CSF o un análogo químico de G-CSFR, y en donde dichos análogos químicos son antagonistas de G-CSF o G-CSFR.
11. El agente de una cualquiera de las Reivindicaciones 9 o 10, en donde el agente es una proteína.
12. El agente de una cualquiera de las Reivindicaciones 1 a 6, en donde el agente es un ácido nucleico.
13. El agente de la reivindicación 12, en donde el ácido nucleico es ADN o ARN y que comprende una secuencia de polinucleótido codificante y anticodificante o una secuencia genética que codifica G-CSF o G-CSFR.
14. Uso de un agente que inhibe la actividad del factor que estimula la colonia de granulocito (G-CSF), o el receptor del factor que estimula la colonia de granulocito (G-CSFR) y/o que reduce el nivel de expresión de un gen que codifica dicho G-CSF o G-CSFR, en la fabricación de un medicamento para el tratamiento o profilaxis de artritis en un sujeto, en donde dicha artritis, sujeto y agente son como se define en una o más de las Reivindicaciones 1 a 13.
15. Un método no terapéutico in vivo para identificar agentes capaces de inhibir la actividad de G-CSF y/o inhibir la interacción de G-CSF con G-CSFR, dicho método comprende administrar un agente inhibidor putativo a un animal no humano genéticamente modificado que se ha modificado para producir cantidades bajas de G-CSF o G-CSFR con relación a un animal no modificado genéticamente de la misma especie, en donde dicho agente se identifica por tener interactividad con G-CSF o G-CSFR por el agente que tiene un efecto fisiológico detectable en un animal tipo intacto de la misma especie, pero un efecto reducido en un animal que exhibe expresión reducida de G-CSF y/o G-CSFR.
Patentes similares o relacionadas:
Anticuerpos anti-alfa-sinucleína y procedimientos de uso, del 29 de Julio de 2020, de F. HOFFMANN-LA ROCHE AG: Un anticuerpo anti-alfa-sinucleína humana que comprende (a) HVR-H1 que comprende la secuencia de aminoácidos de SEQ ID NO: 21; (b) HVR-H2 que […]
Formulaciones estabilizadas que contienen anticuerpos anti-receptor de interleucina 4 (IL-4R), del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Una jeringuilla precargada que contiene una formulación farmacéutica líquida estable, en la que la formulación farmacéutica líquida comprende: […]
Métodos y composiciones para tratar y prevenir enfermedades asociadas con la integrina AVB8, del 29 de Julio de 2020, de THE REGENTS OF THE UNIVERSITY OF CALIFORNIA: Un anticuerpo aislado que se une específicamente a la integrina β8 humana e inhibe la adhesión del péptido asociado a latencia (LAP) a ανβ8, en donde el […]
 Métodos para producir proteínas bicatenarias en bacterias, del 29 de Julio de 2020, de GENENTECH, INC.: Un método para producir un receptor de linfocitos T monoclonal de movilización inmunitaria contra el cáncer (ImmTAC) que comprende una cadena alfa del receptor de linfocitos […]
Métodos para producir proteínas bicatenarias en bacterias, del 29 de Julio de 2020, de GENENTECH, INC.: Un método para producir un receptor de linfocitos T monoclonal de movilización inmunitaria contra el cáncer (ImmTAC) que comprende una cadena alfa del receptor de linfocitos […]
Proteínas de unión al antígeno ST2, del 22 de Julio de 2020, de AMGEN INC.: Un anticuerpo aislado que se une a un antígeno ST2 que tiene la secuencia de aminoácidos 19-556 del SEQ ID NO: 1, comprendiendo dicho anticuerpo una secuencia de […]
Método para producir inmunoconjugados de anticuerpo-SN-38 con un enlazador CL2A, del 22 de Julio de 2020, de IMMUNOMEDICS, INC.: Un método para producir un compuesto, CL2A-SN-38, que presenta la estructura, **(Ver fórmula)** que comprende realizar un esquema de reacción como el que se muestra: **(Ver […]
Bloqueo de CD73, del 22 de Julio de 2020, de Innate Pharma: Un anticuerpo aislado que específicamente se une a un polipéptido CD73 humano en la superficie de una célula y que tiene capacidad de neutralizar […]
Composición de anticuerpos monoclonales dirigidos contra BDCA-2, del 22 de Julio de 2020, de LABORATOIRE FRANCAIS DU FRACTIONNEMENT ET DES BIOTECHNOLOGIES: Composición de anticuerpos monoclonales dirigidos contra la proteína BDCA-2, presentando dichos anticuerpos un porcentaje de fucosilación inferior al 60% […]